
繼8月份叫停械字號(詳見《重磅丨上海叫停械字號!》)后,上海市對械字號的監管又了新進展。
日前,上海市藥品監督管理局發布《上海市第一類醫療器械備案工作指南》(下稱《指南》),對上海市第一類醫療器械產品備案、第一類醫療器械生產備案兩部分的監管內容劃出了重點,對械字號產品的名稱、型號/規格的表述方式、配方成分等方面提出了詳細要求。
此次指南明確指出,本工作指南不作為法規強制執行,但隨著法規的不斷完善,將適時對相關內容予以調整。品觀APP了解到,監管緊箍咒下,部分企業已經按照指南要求開始規范生產了。
01:劃重點,這些是備案禁用詞
指南明確指出,備案依據出自于此前已發布的部分條例法規。換言之,此次指南相當于對此前所有相關備案要求進行了歸納總結。品觀APP梳理發現,監管重點主要集中在以下幾個方面。
1.備案依據須明確標注文件來源
指南指出,備案人在符合性聲明中應注明確切的產品分類依據。在標注依據時,備案人還需要詳細注明所屬子目錄、相應序號、產品類別以及具體文號等詳細內容。
解讀:備案出處更加細化。例如,符合性聲明中寫“本產品屬于《第一類醫療器械產品目錄》中的第一類產品目錄17-04的有關內容”,屬于正確操作。如果僅寫“屬于《第一類醫療器械產品目錄》中相關內容”,則屬于不合規表述。
2.規范品名/型號等表述,禁用消痘型、抗炎型等詞語
指南指出,產品名稱不應包含以下幾個方面內容:產品的型號或規格,人名、企業名、品牌名、商標名或其它類似的名稱;絕對化或排他性的詞語,如最佳、最新、唯一、精確、速效等;明示或者暗示對某種疾病具有治療作用的詞語,或含有表示功效、說明有效率和治愈率的斷言或者保證;明示或暗示包治百病、適應所有癥狀或者夸大適應癥的內容,或含有美容、保健等宣傳性內容;未經科學發現證明或臨床結果證明,或虛無、假設的概念性名稱。
在規格上,須清晰準確表述產品的全部型號/規格,可使用部位、尺寸、裝量等形式表述,例如:額面型、足底型、手心型、腋窩型;5cm*10cm;5片/盒、5瓶/盒、50g/支等。
對于醫用冷敷貼、醫用冷敷眼罩等械字號產品,關于產品型號/規格的表述內容均不應體現超出備案產品描述以及預期用途范疇的表述內容,例如:修護(修復)型、精華型、消腫止痛型、緩解過敏型、抑制色素沉著型、消痘型、抗炎型等。

在“產品描述”和“預期用途”上,內容也需要和相關目錄保持一致,禁用“通常”、“一般”等表述,需要通過準確表述體現產品技術特點。
解讀:所有文字信息都須規范化表述,不能使用醫學類表達、不能隨便夸大產品功效、不能出現模糊表述。
3.成分監管更嚴格,透明質酸鈉/膠原蛋白等成重點審核對象
指南規定,備案人應在備案資料“生產制造信息”中提交所有添加成分以及含量信息,并如實表述所有成分的作用。
其中需要重點審核的是:使用成分未被《中華人民共和國藥典》收載,以及未被藥典收載的天然植物或其提取物、防腐劑、抑菌劑、透明質酸鈉、膠原蛋白等成分,也不得具有藥理學作用;液體敷料、噴劑敷料、傷口護理軟膏、液體傷口敷料、創口貼等產品配方中添加的相關成分,不可被人體吸收;醫用冷敷貼等產品配方中降溫物質,不得發揮免疫學或者代謝作用的成分。
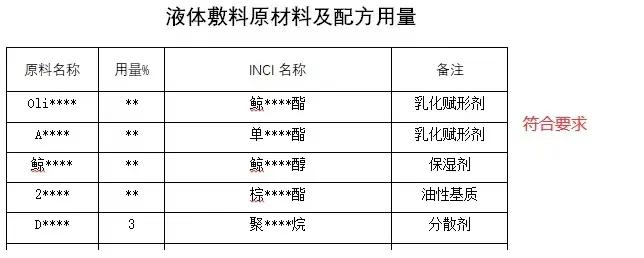
指南指出,若備案人認為產品配方中添加的相關成分符合上述標準,應提供相應的證明材料。備案部門與備案人就此無法達成一致意見時,可建議備案人按規定申請分類界定。
解讀:簡言之,械字號產品不能和藥品混為一談,不能添加有藥理學作用的成分,不能產生相關藥品功效,并需要企業提供相關證明材料。
02:械字號要涼涼了?
械字號產品,攪熱了近兩年的化妝品市場。
上海市藥品監督管理局官方數據顯示,截至2019年,上海市持有有效期內醫療器械生產許可證企業955家。其中,持有一類醫療器械生產許可證的企業有255家,占比達26.7%。截至2019年底,全國實有醫療器械生產企業1.8萬家,其中可生產一類產品的企業8232家。
根據品觀APP此前報道,今年上半年開始,上海開始收緊對械字號企業的監管,多家企業的一類醫療器械生產資質在今年五六月份被撤銷,企業需要重新申請并拿到新的資質后,才能恢復生產。
品觀APP從數家擁有械字號生產資質的上海工廠處了解到,目前它們尚未恢復械字號產品的生產,恢復時間也不得而知。
有行業人士表示,監管政策將會從上海蔓延至其他地區。但日前,有分別在山東和上海兩地開設工廠的械字號生產企業表示,其在山東的工廠一直沒有停止過械字號產品的生產。
無論如何,此次指南的發布,無疑是對還在等待中的上海械字號企業又一擊重創。
上海璞萃生物科技有限公司市場部經理黃建東表示,與此前相比,《指南》對械字號產品生產工廠的要求更嚴格,具體表現為申請資質更加嚴格,生產產品更加規范,對產品的配方要求更加嚴格、不能添加任何化學試劑。
其中,對成分的監管力度可謂前所未有。針對《指南》中提到的“若備案人認為產品配方中添加的相關成分不具有藥理學作用、不可被人體吸收;其中降溫物質不發揮藥理學、免疫學或者代謝作用,應提供相應的證明材料”這一內容,上海某ODM/OEM企業相關負責人,具體的證明材料和要求都沒有明確的規定,“證明怎么寫?配方怎么做?這些都是頭大的事情。”
那么,《指南》對械字號產品的監管進一步收緊后,械字號市場熱度是否會降溫?
“其實《指南》對于本身資質齊全的企業來說沒什么影響,功效驗證肯定是要做的,按照醫藥的標準來做械字號,肯定是要做臨床實驗的。只是公司正在評估繼續做械字號的必要性,主要因為現在做械字號沒辦法做功效用詞的宣傳。”
一生產械字號產品的企業負責人認為,在企業看來,與其堅持用這些成分,提供不具藥理學作用的證明材料,還不能宣傳成分功效,還不如直接按照規定不進行成分添加。黃建東也告訴品觀APP,“之前一家專門做械字號的企業,最近也改了醫用冷敷貼的配方,將透明質酸鈉從配方中去掉了。”
還有幾個械字號產商也表示,目前集團正在考慮是否繼續做械字號,“因為現在這個已經不是一個普通領域了,是極其需要專業知識的領域,很難做。”具體表現為,隨著備案政策不斷收緊,生產械字號產品成為了企業的入局門檻,并不是什么公司都能申請到;另一方面,市場在變,規則在變,產品也必須要變,整個械字號產品配方可能要調整,這也需要很長時間的磨合。
不過,從市場層面看,上述負責人認為,械字號市場熱度肯定不會降低,“因為需要的人還是有很多,但是能生產械字號的企業會變少,慢慢變成供不應求,熱度會再次升高。”
Copyright ? 2012 - 2022 廣州旭妝生物科技有限公司 All Rights Reserved 粵ICP備15011994號 網站地圖